- by yu, angie
- 2017-10-17,
- 关闭评论
[流通池法溶出度测试] 最小化仿制药生物不等效的风险
2016 年,国家食品药品监督管理总局 CFDA 有关公告明确了仿制药一致性评价的对象和时限。大部分化学药品仿制药口服固体制剂,原则上应在 2018 年底前完成一致性评价。
因此,绝大多数需要通过体内生物等效性试验 (BE) 来证实自研产品与原研产品在临床使用上的可替代性,即疗效和安全性一致。这意味着临床试验机构的需求量极大。

生物等效性实验 (BE):是通过对比仿制制剂和对照制剂 (原研药) 在人体内吸收的程度和速度的异同,来判定仿制制剂与原研制剂的药效学异同,体内一致可以说是仿制药临床前研究阶段的终极目标。
但由于生物等效性实验 (BE) 试验的复杂性决定了试验的进行时间周期长、费用高,因此在研发实际的操作过程中,对每一批次的样品都进行生物等效性实验 (BE) 测试显然是不现实的,特别在处方和工艺摸索阶段中更为明显。
而体外的溶出度试验,可以有效地反映体内的溶出情况,因而是药品在处方和工艺筛选阶段,以及上市产品质量控制阶段的一个有效方式。
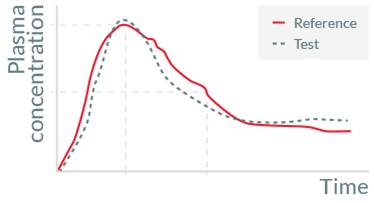
而溶出度测试作为仿制药开发中的重要手段,无疑是制药企业提升工作效率的关键。一个良好的溶出度测试方法,可以有效地预测体内的溶出行为,从而增加生物等效性实验 (BE)的成功率。
流通池法溶出度测试 (美国药典第四法):是利用溶出介质的流动来溶解药品的,更接近于人体内的循环方式,更为真实地反映了药物在体内的溶出行为,大大增加了体外方法预测体内行为的可靠性。
案例分析:
某公司的 A 片剂 (属生物药剂系统分类学 [BCS 1]的产品) 在 20 多年前上市销售, 专利到期后,其它公司进行了仿制 (B 片剂)。通过几次运用原有官方公布的体外溶出度方法进行测试后发现 B 与 A 体内生物不等效,排查后发现有可能是溶出试验方法选择不恰当,导致没有及时发现 B 与 A 的体外溶出差异。
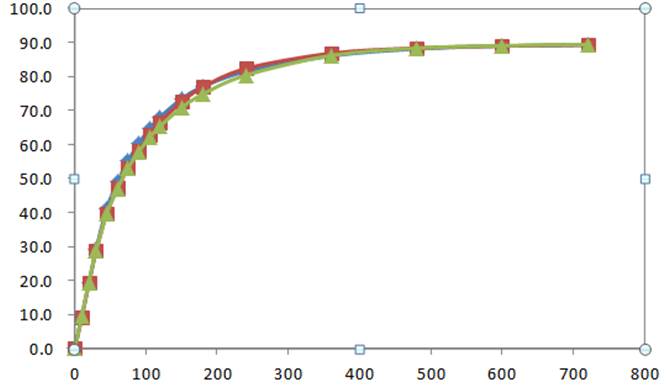
研究人员采用流通池法代替原有的桨法,在保持其他实验条件不变的情况下进行溶出度测试,发现 B 与 A 在体外也存在差异,而且这种差异的趋势与体内的情况一致。最后重新利用流通池法来筛选处方,获得与原研 A 产品相似的 C 产品之后,第二次去做生物等效性实验,仿制的 C 产品与原研 A 产品体内行为一致,成功仿制了 A 产品。

溶出度方法开发出来了,与原研药对比一致,生物等效性实验的结果却显示两者相差甚远,不得不回头重新寻找原因,重新开发溶出度方法进行评估,时间和金钱都消耗了。流通池法作为一种相对「温和」的溶出度测试方法,更能有效将处方和工艺中的细节差异放大,特别适合仿制药的研发过程。
流通池法在预测体内行为的方法占有极大的优势。流通池法溶出度测试在仿制药的开发中具有非常重要的意义和作用,可以最小化药物在体内生物不等效的风险。
- 标签: BE 生物等效性实验,
- Sotax,
- 流池法,
- 溶出度测试
